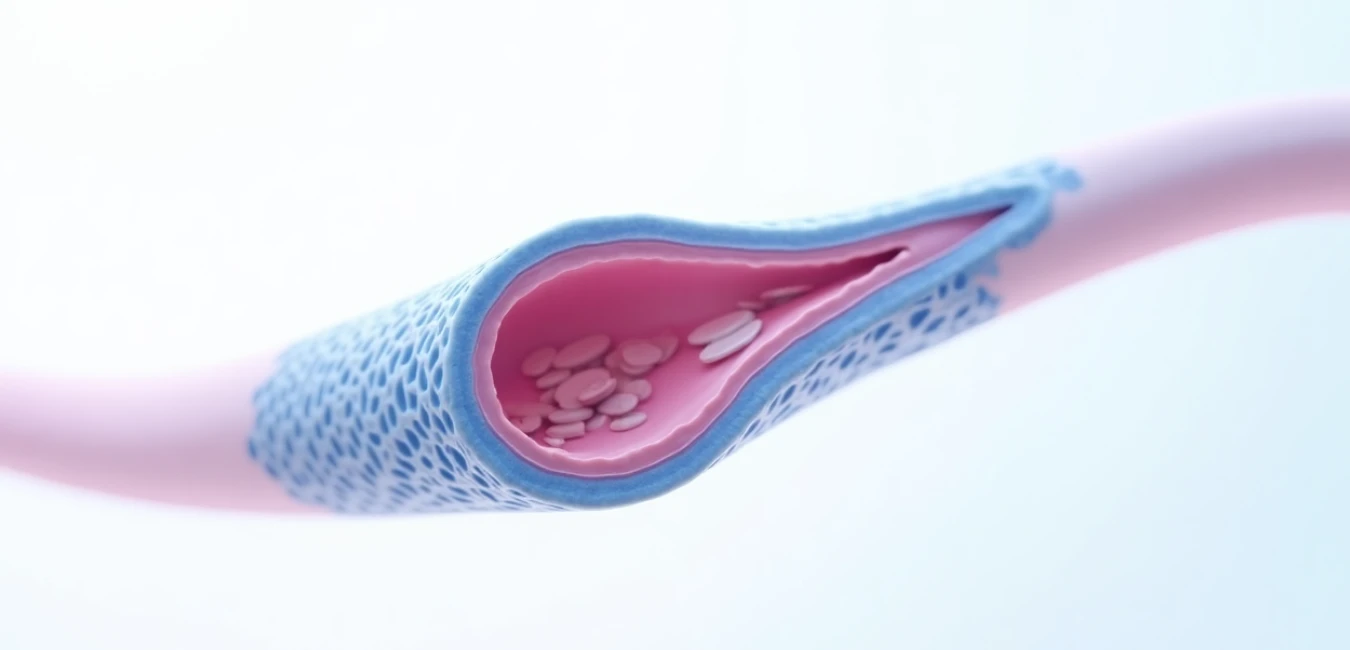
- Jak biodegradowalny implant z tizanidyną może zapewnić kontrolę spastyczności przez 200 dni
- Dlaczego połączenie tizanidyny z lidokainą w jednym implancie rozwiązuje problem bólu pooperacyjnego
- Które techniki wytwarzania pelletów (VCM vs. bezpośrednia kompresja) dają najlepszą kontrolę uwalniania leku
- Jakie korzyści ekonomiczne i kliniczne może przynieść ta technologia pacjentom ze stwardnieniem rozsianym
Czy biodegradowalny implant może zmienić leczenie spastyczności w SM?
Spastyczność dotyka ponad 80% pacjentów ze stwardnieniem rozsianym (SM), powodując sztywność mięśni, mimowolne skurcze i ograniczenie ruchomości. Obecne metody leczenia – terapia doustna i pompy infuzyjne – wiążą się z istotnymi ograniczeniami: działania niepożądane ogólnoustrojowe, konieczność inwazyjnych zabiegów chirurgicznych oraz ryzyko powikłań infekcyjnych. Badacze z University of Nottingham przedstawili innowacyjne rozwiązanie: biodegradowalny implant podskórny łączący tizanidynę (TZ) do kontroli spastyczności z lidokainą (LD) zapewniającą miejscowe znieczulenie po wszczepieniu.
Praca opublikowana w “Drug Delivery and Translational Research” opisuje prekliniczne opracowanie systemu dostarczania leku składającego się z pelletu zawierającego tizanidynę otoczonego tubularną membraną z polikaprolaktonu (PCL). Kluczowym osiągnięciem jest wydłużenie okresu uwalniania leku do 200 dni przy jednoczesnym zapewnieniu kontroli bólu w miejscu implantacji przez pierwsze 3 dni po zabiegu. Technologia ta może zrewolucjonizować terapię przewlekłych stanów neurologicznych, oferując pacjentom komfort długotrwałego działania bez konieczności codziennego przyjmowania leków.
Jak skonstruowano dwulekowy system implantacyjny?
Badacze zastosowali dwie techniki wytwarzania pelletów zawierających tizanidynę: bezpośrednią kompresję oraz próżniowe formowanie kompresyjne (VCM – Vacuum Compression Moulding). Pellety przygotowano zarówno z chlorowodorkiem tizanidyny (TZHCl), jak i zasadą tizanidyny (TZB) w połączeniu z PCL lub mieszaniną PCL-PEG w stosunku masowym 1:1. Każdy pellet ważył około 50 mg i miał wymiary 2,9 mm średnicy oraz 15 mm długości – rozmiar porównywalny z komercyjnymi implantami podskórnymi.
Tubularne membrany kontrolujące uwalnianie leku wytworzono metodą odlewania roztworu polimerowego na obrotowym pręcie metalowym. Membrany składały się z PCL o dwóch masach cząsteczkowych (50 kDa i 550 Da) w proporcji 40:60, osiągając grubość 183±6 µm. Lidokainę wprowadzono do membrany na trzech poziomach: w warstwie zewnętrznej, środkowej lub w dwóch warstwach jednocześnie, co pozwoliło załadować odpowiednio 1,5 mg, 3,3 mg i 6,4 mg LD.
Charakteryzację fizykochemiczną przeprowadzono z wykorzystaniem spektroskopii Ramana, mikroskopii elektronowej (SEM), mikrotomografii komputerowej (µCT), kalorymetrii różnicowej (DSC), analizy termograwimetrycznej (TGA) oraz dyfraktometrii rentgenowskiej (XRD). Badania uwolnienia in vitro prowadzono przez 150 dni w buforze fosforanowym (PBS, pH 7,4) w temperaturze 37°C z wymianą całego medium w każdym punkcie czasowym dla utrzymania warunków sink.
Jak forma tizanidyny wpływa na właściwości implantów?
Analiza mikroskopowa wykazała wyraźne różnice między pelletami zawierającymi TZHCl a TZB. Pellety z zasadą tizanidyny (TZB) charakteryzowały się gładszą powierzchnią, co autorzy przypisują lepszemu mieszaniu hydrofobowej zasady z hydrofobową matrycą PCL. W przeciwieństwie do tego, pellety z TZHCl wykazywały bardziej chropowatą powierzchnię z widocznymi obszarami o wysokim stężeniu leku, potwierdzonymi mapowaniem spektroskopowym Raman.
Spektroskopia Ramana ujawniła, że w pelletach TZHCl-PCL występują wyraźne “punkty” o wysokim stężeniu leku, podczas gdy w formulacjach zawierających PEG rozkład był bardziej równomierny. Dodatek PEG działał jako solubilizator leku w matrycy polimerowej, co tłumaczy szybsze uwalnianie z pelletów TZHCl-PCL-PEG (3 dni) w porównaniu z TZHCl-PCL (25 dni).
Analiza termiczna (DSC) wykazała przesunięcie temperatury topnienia leku w kierunku niższych wartości we wszystkich formulacjach, co wskazuje na interakcje między lekiem a matrycą polimerową. Dla TZHCl temperatura topnienia obniżyła się z 296°C do 295°C (TZHCl-PCL) i 291°C (TZHCl-PCL-PEG). Jeszcze bardziej dramatyczne zmiany zaobserwowano dla TZB – z 225°C do 219°C (TZB-PCL) i 213°C (TZB-PCL-PEG), co potwierdza redukcję krystaliczności leku.
Spektroskopia w podczerwieni (FT-IR) ujawniła przesunięcie piku przy 1604 cm⁻¹ w formulacjach zawierających PEG, sugerując wiązania wodorowe między grupami aminowymi TZHCl a grupami tlenowymi w łańcuchach PEG. Dyfraktometria rentgenowska potwierdziła częściową amorfizację leku we wszystkich formulacjach, z zachowaniem pewnego stopnia krystaliczności.
Jaka jest rola membrany PCL w kontroli uwalniania?
Tubularne membrany PCL pełnią podwójną funkcję: kontrolują tempo uwalniania tizanidyny oraz dostarczają lidokainę dla miejscowego znieczulenia. Porozymetria rtęciowa (MIP) wykazała, że pusta membrana PCL charakteryzuje się jednomodalnym rozkładem porów o średnicy około 10 µm. Wprowadzenie lidokainy do warstw membrany dramatycznie zmieniało strukturę porów.
Gdy LD umieszczono w środkowej warstwie, powstał dwumodalny rozkład porów: małe pory (0,005-0,010 µm) oraz znacząca frakcja dużych porów (20-100 µm). Całkowita porowatość była najwyższa w tej konfiguracji. Umieszczenie LD w warstwie zewnętrznej również dało rozkład dwumodalny, ale z mniejszymi porami w górnym zakresie (2,5-10 µm) i niższą całkowitą porowatością. Najbardziej restrykcyjną strukturę uzyskano w membranie z pięcioma warstwami, w której dwie warstwy (pierwsza i trzecia od zewnątrz) zawierały LD – rozkład porów ograniczał się do 0,005-0,020 µm.
Analiza termiczna membran zawierających LD wykazała pik topnienia lidokainy przy około 79°C (w porównaniu z 81°C dla czystego leku), co wskazuje na fizyczne interakcje między PCL a LD bez zmiany stanu krystalicznego. Membrany z LD charakteryzowały się niższą stabilnością termiczną niż puste membrany PCL, szczególnie wyraźnie w przypadku membrany z dwoma warstwami LD ze względu na wyższy procentowy udział leku.
Jak długo implant dostarcza tizanidynę i lidokainę?
Badania uwolnienia in vitro wykazały istotne różnice między formulacjami w zależności od formy leku i składu polimeru. Pellety wytworzone bezpośrednią kompresją (TZHCL z PVP lub HPBCD) uwalniały lek w ciągu maksymalnie 1 dnia, co dyskwalifikuje tę metodę dla długodziałających implantów. Pellety VCM wykazały znacznie lepszą kontrolę uwalniania.
Pellety bez membrany: TZHCl-PCL uwalniał lek przez 25 dni, TZHCl-PCL-PEG przez 3 dni, TZB-PCL przez 150 dni (96±10% uwolnienia), a TZB-PCL-PEG przez 50 dni (94±1% uwolnienia). Obecność PEG, jako rozpuszczalnego w wodzie polimeru, tworzyła pory podczas procesu uwolnienia, przyspieszając dostarczanie leku.
Pellety z membraną PCL: Dodanie membrany dramatycznie wydłużyło czas uwolnienia. Implant TZHCl-PCL osiągnął 80 dni uwalniania, podczas gdy TZHCl-PCL-PEG – 19 dni. Najlepsze wyniki uzyskano dla implantów z zasadą tizanidyny: TZB-PCL utrzymywał uwalnianie przez 200 dni (93±5% uwolnienia) z niemal liniowym profilem, a TZB-PCL-PEG przez 130 dni (89±7% uwolnienia).
Uwalnianie lidokainy: Niezależnie od typu membrany (LD w ostatniej warstwie, środkowej warstwie lub w dwóch warstwach), lidokaina uwalniała się przez 1-3 dni z ponad 90% skutecznością. Membrany z dwoma warstwami LD zapewniały najdłuższe działanie – 3 dni, z uwolnieniem 89±23% (dla implantów z TZHCl) i 91±32% (dla implantów z TZB). Ten okres jest wystarczający do kontroli bólu pooperacyjnego, który zazwyczaj ustępuje w ciągu 1-2 tygodni przy skutecznej terapii.
Analiza SEM po zakończeniu badań uwolnienia ujawniła, że obecność PEG skutkowała bardziej porowatą strukturą matrycy polimerowej, potwierdzając mechanizm erozyjny uwalniania związany z tym rozpuszczalnym w wodzie polimerem.
Jakie korzyści może przynieść taki implant pacjentom z SM?
Opracowany system implantacyjny oferuje kilka istotnych przewag nad obecnymi metodami leczenia spastyczności w stwardnieniu rozsianym. Terapia doustna tizanidyną wiąże się z ogólnoustrojowymi działaniami niepożądanymi (senność, osłabienie, problemy żołądkowo-jelitowe) oraz niską biodostępnością doustną. Pompy infuzyjne baclofenu, choć skuteczne w dostarczaniu leku bezpośrednio do płynu mózgowo-rdzeniowego, wymagają inwazyjnej operacji chirurgicznej i ciągłego monitorowania w celu uniknięcia powikłań takich jak infekcje czy awarie pompy.
Podskórne implanty biodegradowalne oferują mniej inwazyjną alternatywę z długotrwałym, kontrolowanym uwalnianiem leku. Dzięki ominięciu przewodu pokarmowego system ten może zapewnić bardziej stabilną kontrolę spastyczności przy mniejszej liczbie działań niepożądanych ogólnoustrojowych. Biorąc pod uwagę niską biodostępność doustną TZ, opracowane implanty mogą uwalniać 0,2-3 mg leku dziennie – dawkę potencjalnie wystarczającą do skutecznego leczenia podskórnego.
Aspekt ekonomiczny jest równie istotny. Roczne koszty związane ze spastycznością w SM wahają się od £217 we wczesnych stadiach do £33 163 w późniejszych fazach choroby w Wielkiej Brytanii. Wczesne zarządzanie spastycznością znacząco redukuje całkowite koszty leczenia choroby. Implanty mogłyby zmniejszyć liczbę hospitalizacji z powodu nawrotów oraz obniżyć obciążenie systemu opieki zdrowotnej – pacjenci z chorobami przewlekłymi stanowią około 50% wszystkich wizyt u lekarza rodzinnego, ponad 70% wszystkich dni łóżkowych w szpitalach i 64% wszystkich wizyt ambulatoryjnych.
Badania perspektyw pacjentów dotyczących implantów w leczeniu SM wykazały preferencję dla tego podejścia nad konwencjonalnymi terapiami ze względu na zmniejszone ryzyko nawrotów. Pacjenci deklarowali gotowość do pewnego kompromisu w skuteczności leczenia w zamian za przejście z regularnych iniekcji na długoterminowy implant.
Czym różni się ten system od istniejących rozwiązań?
Na rynku istnieją alternatywne implanty do leczenia spastyczności, takie jak pompy do podawania dokanałowego baclofenu. Są to jednak aktywne implanty zawierające pompy perystaltyczne, co czyni je kosztownymi – w niektórych przypadkach wysokie koszty doprowadziły do ich wycofania z rynku mimo skuteczności klinicznej.
Firma Delpor opracowała podskórny implant tizanidyny do utrzymania leczenia spastyczności przez 3-6 miesięcy. Te implanty typu reservoir wykonane są z tytanu z półprzepuszczalną membraną i wykorzystują opatentowaną technologię Prozor, która łączy lek z biodegradowalnymi polimerami tworzącymi kwaśne środowisko wewnątrz implantu, zwiększając rozpuszczalność leku i umożliwiając uwalnianie zerowego rzędu.
W przeciwieństwie do implantów tytanowych Delpor, system opisany w tej publikacji jest w pełni biodegradowalny. Choć degradacja potrwa dłużej niż uwalnianie leku (co oznacza, że implanty do przewlekłego stosowania wymagałyby usunięcia i wymiany), technologia ta może być wykorzystana w zastosowaniach jednorazowych, takich jak kontrola bólu pooperacyjnego lub pourazowego, bez konieczności usuwania. Dodatkowo PCL i farmaceutyczne substancje pomocnicze są bardziej opłacalne niż tytan, co czyni opisane implanty tańszą opcją terapeutyczną.
Innowacyjnym elementem przedstawionego systemu jest połączenie dwóch leków w jednym implancie: tizanidyny do długoterminowej kontroli spastyczności oraz lidokainy do krótkookresowego znieczulenia miejscowego po wszczepieniu. Ta kombinacja bezpośrednio odpowiada na jeden z głównych problemów implantów podskórnych – ból i dyskomfort w miejscu wszczepienia, który doświadcza ponad 80% pacjentów po zabiegach chirurgicznych.
Jakie wyzwania stoją przed wdrożeniem tej technologii?
Mimo obiecujących wyników in vitro, opracowany system wymaga dalszych badań przed potencjalnym zastosowaniem klinicznym. Kluczowym ograniczeniem jest brak badań in vivo, które potwierdziłyby skuteczność i bezpieczeństwo dostarczania TZ oraz LD z implantu podskórnego. Badania na modelach zwierzęcych są niezbędne do oceny farmakokinetyki, biodostępności oraz odpowiedzi tkankowej na implant.
Długoterminowa degradacja implantu pozostaje obszarem wymagającym szczegółowej oceny. Choć PCL jest biodegradowalnym polimerem, proces jego degradacji w warunkach in vivo może przebiegać inaczej niż w badaniach in vitro. Należy zbadać, czy produkty degradacji są bezpieczne, jak szybko są eliminowane z organizmu oraz czy nie wywołują reakcji zapalnej lub innych niepożądanych odpowiedzi immunologicznych.
Rozmiar i kształt implantu (2,9 mm średnicy, 15 mm długości) są porównywalne z komercyjnymi implantami takimi jak Nexplanon, co sugeruje możliwość minimalnie inwazyjnego wszczepienia. Jednak dokładna procedura implantacji, wymagane narzędzia oraz potencjalne powikłania wymagają walidacji klinicznej. Autorzy wspominają o możliwości przygotowania większych implantów (do 4 cm długości, 4 mm średnicy) lub ładowania kilku pelletów w jednej membranie dla dostosowania dawki do potrzeb pacjenta – te opcje również wymagają systematycznej oceny.
Kwestia resztkowych rozpuszczalników organicznych (DCM) używanych w procesie produkcji została częściowo zaadresowana – autorzy potwierdzają, że zawartość DCM pozostaje poniżej limitu FDA (50 ppm), a wcześniejsze badania cytotoksyczności podobnych implantów nie wykazały efektów toksycznych. Niemniej jednak, pełna walidacja bezpieczeństwa produkcji wymaga rozszerzonych testów toksykologicznych.
Wreszcie, należy rozważyć perspektywę ekonomiczną i regulacyjną. Choć PCL i substancje pomocnicze są tańsze niż tytan, całkowity koszt produkcji, dystrybucji i implantacji wymaga szczegółowej analizy ekonomicznej. Proces rejestracji takiego produktu jako wyrobu medycznego lub leku będzie wymagał spełnienia rygorystycznych wymagań regulacyjnych dotyczących jakości, bezpieczeństwa i skuteczności.
Czy biodegradowalne implanty staną się przyszłością terapii SM?
Opracowany przez naukowców z University of Nottingham biodegradowalny implant podskórny reprezentuje innowacyjne podejście do leczenia spastyczności w stwardnieniu rozsianym. System łączący długoterminowe dostarczanie tizanidyny (do 200 dni) z krótkookresowym znieczuleniem lidokainą (3 dni) odpowiada na kluczowe ograniczenia obecnych terapii: konieczność codziennego przyjmowania leków, działania niepożądane ogólnoustrojowe oraz inwazyjność procedur. Najlepsze wyniki uzyskano dla implantów zawierających zasadę tizanidyny (TZB-PCL) z membraną PCL, które utrzymywały niemal liniowy profil uwalniania przez ponad 6 miesięcy.
Technologia ta oferuje potencjalne korzyści zarówno dla pacjentów (lepsza jakość życia, mniejsza liczba działań niepożądanych), jak i systemu opieki zdrowotnej (redukcja hospitalizacji, niższe koszty leczenia). Pełna biodegradowalność i niższy koszt produkcji w porównaniu z implantami tytanowymi lub aktywnymi pompami infuzyjnymi dodatkowo wspierają atrakcyjność tej technologii. Niemniej jednak, droga od obiecujących wyników preklinicznych do zastosowania klinicznego wymaga przeprowadzenia badań in vivo, walidacji bezpieczeństwa długoterminowego oraz spełnienia wymogów regulacyjnych. Dalsze badania powinny skupić się na ocenie farmakokinetyki, odpowiedzi tkankowej oraz optymalizacji parametrów implantacji dla zapewnienia maksymalnej skuteczności i bezpieczeństwa terapii.
Pytania i odpowiedzi
❓ Jak długo implant z tizanidyną może kontrolować spastyczność?
Najskuteczniejsza formulacja – implant zawierający zasadę tizanidyny z membraną PCL (TZB-PCL) – zapewnia kontrolowane uwalnianie leku przez 200 dni, osiągając 93±5% całkowitego uwolnienia. Profil uwalniania jest niemal liniowy, co oznacza stabilne dawkowanie przez cały okres działania. W zależności od składu implantu i formy leku, czas działania może wynosić od 19 do 200 dni.
❓ Czy lidokaina w membranie skutecznie łagodzi ból po wszczepieniu?
Tak, lidokaina wprowadzona do membrany PCL uwalnia się przez 1-3 dni z ponad 90% skutecznością, niezależnie od konfiguracji warstw. Najdłuższe działanie (3 dni) zapewniają membrany z dwoma warstwami lidokainy, co jest wystarczające do kontroli bólu pooperacyjnego, który zazwyczaj ustępuje w ciągu 1-2 tygodni przy skutecznej terapii.
❓ Dlaczego metoda VCM jest lepsza od bezpośredniej kompresji?
Metoda próżniowego formowania kompresyjnego (VCM) zapewnia lepszą jednorodność pelletów i znacznie dłuższe uwalnianie leku w porównaniu z bezpośrednią kompresją. Pellety wytworzone bezpośrednią kompresją uwalniały lek w ciągu zaledwie 1 dnia, podczas gdy pellety VCM utrzymywały kontrolowane uwalnianie przez 25-150 dni w zależności od składu. VCM pozwala na lepsze mieszanie leku z polimerem i tworzenie stabilnej matrycy.
❓ Jakie są główne zalety tego implantu nad terapią doustną?
Implant podskórny omija przewód pokarmowy, co eliminuje problemy z niską biodostępnością doustną tizanidyny i zmniejsza ryzyko działań niepożądanych ogólnoustrojowych (senność, osłabienie, problemy żołądkowo-jelitowe). Długotrwałe, kontrolowane uwalnianie leku (do 200 dni) zapewnia stabilną kontrolę spastyczności bez konieczności codziennego przyjmowania tabletek, co poprawia adherencję pacjentów i może zmniejszyć liczbę hospitalizacji.
❓ Jakie badania są jeszcze potrzebne przed zastosowaniem klinicznym?
Kluczowe są badania in vivo na modelach zwierzęcych dla oceny farmakokinetyki, biodostępności i odpowiedzi tkankowej na implant. Niezbędna jest również szczegółowa ocena długoterminowej degradacji PCL w warunkach fizjologicznych, bezpieczeństwa produktów degradacji oraz walidacja procedury implantacji. Wymagane są także rozszerzone testy toksykologiczne i spełnienie rygorystycznych wymogów regulacyjnych przed rejestracją produktu.